简介
英文名:Gatifloxacin
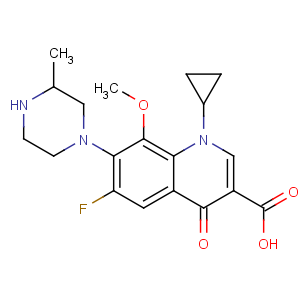
化学名称:1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-(3-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸
分子式:C19H22FN3O4
分子量:375.40
药理作用
体外试验和临使用结果均表明,对以下微生物的大多数菌株具有抗菌活性:
1、革兰氏阳性菌:金黄色葡萄球菌(仅限于对甲氧西林敏感的菌株)、肺炎链球菌(对青霉素敏感的菌株)。
2、革兰氏阴性菌:大肠杆菌、流感和副流感嗜血杆菌、肺炎克雷伯杆菌、卡他莫拉菌、病奈瑟菌、奇异变形杆菌。
3、其他微生物:肺炎衣原体、嗜肺性军团杆菌、肺炎支原体。
毒理研究
遗传毒性
Ames试验中本品对多种菌株无致突变作用,但是体外对沙门氏菌株TA102的有致突变作用。中国仓鼠V79细胞的基因突变和中国仓鼠CHL/IU细胞的遗传学试验结果均为阳性。类似的结果在其它喹诺酮类的药物也可见,这可能是由高浓度下本品对真核生物的II型DNA拓扑异构酶的抑制作用所致。本品经口和静脉给药的小鼠微核试验、大鼠经口给药的细胞遗传学试验、大鼠经口给药的DNA修复试验结果均为阴生。
生殖毒性
大鼠经口给予剂量高达200mg/kg(以每天全身暴露量(AUC)计,与人最大推荐剂量等效),对大鼠生育力和生殖无不良反应。大鼠和家兔口予剂量分别150mg/kg和50mg/kg(以AUC计,约为人最大推荐剂量的0.7和1.9倍),未见有致畸胎作用。但是,大鼠在器官形成期,经口或静脉给予剂量分别达200mg/kg和60mg/kg可引起胎儿骨骼畸形;经口或静脉给予剂量分别≥150mg/kg和≥30mg/kg时,可引起胎儿骨骼骨化延迟,包括出现波形肋骨。提示在此剂量下,有轻度的胎儿毒性。此毒性在其它的喹诺酮类药物也可见。
大鼠在妊娠后期最初阶段经口给药剂量达200mg/kg,并持续给药至哺乳期,可见后期的植入后胚胎丢失增加和新生儿和围生期的死亡率升高。这些发现也提示了本品的胎儿毒性。
由于尚无列在怀孕妇女进行的充分和严格的研究,所以怀孕期间,只有在本品对母亲的潜在临利益大于对胎儿的危害时才能使用本品。本品可从大鼠乳汁中分泌,但是尚不知是否可从人乳中分泌。由于许多药物可从人乳中分泌,所以哺育期妇女应慎用。
加替沙星在受孕大鼠致畸敏感期(受孕第6―15天)口服给药,剂量分别为192、96、48mg/kg。试验结果表明加替沙星使高剂量组孕鼠体重增长减慢,活胎数减少,死胎增多:使高、中、低剂量组胎鼠体重减轻,吸收胎增加,骨骼发育迟缓,但外观、骨骼及内脏检查未见加替沙星对胎鼠有明显的致畸胎作用。
致癌性
B6C3F1小鼠经掺食给药18月,雌、雄动物剂量分别为90mg/kg和81mg/kg【以每天全身暴露量(AUC)计,约为人最大推荐剂量的0.13和0.18倍】;Fischer344大鼠经掺食给药2年,雌、雄动物剂量分别为139mg/kg和47mg/kg(以AUC计,约为人最大推荐剂量的0.18和0.36倍),结果均未提示本品有促进肿瘤生长的作用,但是雄性动物当剂量达100mg/kg(以AUC计,约为人最大推荐剂量的0.74倍)时,与对照组相比,可增加巨粒细胞淋巴(LGL)白血病的发生率,这种增加稍高于已有历史性对照的范围,但是并不能认为雄性动物高剂量下的这些发现会影响到本品临用药的安全性。
革兰氏阴性菌:大肠杆菌、流感嗜血杆菌、副嗜沫嗜血杆菌、肺炎杆菌、卡他莫拉菌、淋病奈瑟菌、奇异变形相菌。
其他微生物:肺炎原体、肺炎衣原体、肺炎军团菌、肺炎支原体。
加替沙星对抗下列微生物的体外最小抑菌浓度为小于2μg/ml(对肺炎链球菌为1μg/ml),但加替沙星临床感染的治疗中的安全和有效性还尚未可知:
革兰氏阳性菌:腐生葡萄球菌、肺炎链球菌、化脓链球菌。
革兰氏阴性菌:鲁氏不动杆菌、弗氏柠檬酸菌、产气肠杆菌、阴沟肠杆菌、奥克西托克伯杆菌、摩氏摩根菌。
厌氧菌:消化链球菌属
毒理作用
急性毒性
加替沙星小鼠灌胃给药的LD50为1646.84mg/kg(其95%可信限为1418.85-1911.47mg/kg),大鼠灌胃的LD50为1849.71mg/kg(其95%可信限为1592.92-2147.89mg/kg)。
长期毒性
加替沙星大鼠及Beagle犬灌胃与口服13周,血液学、血生、化学、尿、粪常规等均正常,唯高剂量组出现肝细胞脂肪变性,但可恢复。
遗传毒性
采用培养的中国仓鼠肺细胞(CHL)进行的染色体畸变试验中,在代谢活化和非活化条件下,细胞的染色体畸变率均低于5%,说明加替沙星未使CHL细胞染色体畸变率明显增加。
药代动力学
据文献报告,加替沙星口服吸收良好,且不受饮食因素影响,其绝对生物利用度为96%,药物浓度在服用1-2小时后达峰。
在临床推荐剂量范围内,加替沙星血药峰浓度(Cmax)和血药时曲线下面积随剂量成比例增加。口服本品200mg至800mg连续14天,加替沙星的药动学呈线性的非时间信赖性。每天一次连续用药,在第三天口服或注射日常剂量后即可达到稳态血药浓度。每日1次,每次400mg,其平均稳态峰浓度和谷浓度为:口服4mg/L和0.4mg/L。
分布
加替沙星血清蛋白结合率为20%,与浓度无关。加替沙星在唾液中的浓度与其在血浆中大致相等。加替沙星广泛地分布在许多组织和液体中,在靶组织中的浓度较血清高(表1)。
加替沙星无酶诱导作用,不改变自身和其他合用药物的清除代谢。加替沙星在体内代谢极低,主要以原形经肾脏排出。口服本品后48小时,药物原形在尿中的回收率达70%以上,而其乙二胺和甲基乙二胺代谢物在尿中的浓度不足摄入量的1%,加替沙星平均血浆消除半衰期7~14小时。本品口服或静脉注射后,粪便中加替沙星的原药回收率约5%,提示加替沙星也可经胆道和肠道排除。
适用人群
老年人(≥65岁)男女受试者单剂量口服400mg加替沙星后,仅发现老年女性受试者与年轻女性相比有轻微的药代动力学差异,老年女性的血药峰浓度增加21%,曲线下面积增加32%。这种差异主要是由于肾功能随年龄增加而减退,应根据肾功能情况,决定用量。
中度肝功能不全病人,一次口服400mg加替沙星,血药峰浓度和曲线下面积值较正常肝功能受试者分别轻度增高32%和23%。由于喹诺酮类的抗菌活性呈浓度依赖性,因此在这类病人中,血药峰浓度轻微增高,并不降低加替沙星的疗效。故该类患者使用本品无须调整剂量。尚无重度肝损害病人中加替沙星的药代动力学资料。
不同程度肾功能不全者单次口服400mg加替沙星,随肾功能下降的程度不同加替沙星的表观总清除率(CI/F)相应降低,曲线下面积(AUC)相应增加。中度肾功能不全(肌酐清除率30~40ml/min)病人加替沙星清除率减少57%,重度(肌酐清除率<30ml/min)病人则减少77%。与肾功能正常受试者相比,中度肾功能不全者的加替沙星的全身暴露量增加2倍,重度肾功能不全者增加4倍。平均峰浓度略有增高。建议肌酐清除率<40ml/min,包括需要血液透析和腹膜透析者,加替沙星减量使用。
Ⅱ型糖尿病(非胰岛素依赖性糖尿病)患者每天口服本品400mg,连续10天,药代动力学参数,葡萄糖耐量试验和葡萄糖体内稳定性试验(空腹血清葡萄糖,血清胰岛素和C-肽测定)与健康人相似。首剂静脉注射或口服加替沙星后,血清胰岛素一过性轻度增加和血糖降低。经优降糖治疗已控制病情的糖尿病人多次口服本品,虽服药后血清胰岛素浓度降低,但无血糖水平变化。
适应症
本品主要用于由敏感病原体所致的各种感染性疾病,包括慢性支气管炎急性发作,急性鼻窦炎,社区获得性肺炎,单纯性尿路感染(膀胱炎)和复杂性尿路感染,急性肾盂肾炎,男性淋球菌性尿路炎症或直肠感染和女性淋球菌性宫颈感染。
禁忌
本品禁用于对加替沙星或喹诺酮类药物过敏者。
糖尿病患者禁用。
【警告】血糖异常
已有报道加替沙星引起的血糖异常,包括症状性低血糖症和高血糖症。这些事件通常在糖尿病患者中发生。但是,低血糖症,特别是高血糖症已经在没有糖尿病病史的患者中产生。除了糖尿病以外,服用加替沙星时与血糖代谢异常相关的其他危险因素包括老年患者、肾功能不全、影响葡萄糖代谢的合并用药(特别是降血糖用药)。具有这些危险因素的患者应该密切监控血糖。如果用加替沙星治疗的任何患者发生低血糖或者高血糖的症状和体征,必须立刻进行适当的治疗,并应该停用加替沙星。
已有报道血糖的暂时异常,通常包括开始治疗3天内血清胰岛素水平升高和血糖水平降低,有时导致严重低血糖症。也已经观察到了高血糖症,甚至某些病例为严重高血糖症。高血糖症通常在应用加替沙星第3天后发生。
在加替沙星上市后,已有报道应用加替沙星治疗的患者中极少数出现严重血糖异常。这些异常包括高渗性非酮症高血糖昏迷、糖尿病酮症酸中毒、低血糖昏迷、痉挛和精神状态改变(包括意识丧失)。虽然少数导致致死后果,但是如果得到适当处理,这些事件中大多数是可逆的。
药品不良反应
警惕加替沙星引起的血糖异常
加替沙星,为人工合成的氟喹诺酮类抗菌药,抗菌谱广,尤其对革兰氏阳性菌有较强的抗菌活性。在我国,加替沙星最早于2002年获得批准,主要用于治疗呼吸系统、泌尿系统感染以及由淋球菌引起的性传播疾病。商品名包括:莱美清、奥维美、海超、乐派、悦博、罗欣严达等。
目前,世界卫生组织(WHO)药品不良反应数据库中,有关加替沙星的不良反应报告共2500余例,不良反应表现共计6178例次,其中糖代谢异常表现938例次(占15%),包括高血糖、低血糖、糖尿病、糖耐量异常、高血糖昏迷、低血糖昏迷等。
1988年至2006年5月,国家药品不良反应监测中心病例报告数据库中有关加替沙星的病例报告共3000多例,主要为胃肠道反应、过敏样反应、神经系统反应、注射部位损害等。其中,血糖异常报告16例,包括高血糖10例(1例出现高渗性非酮症高血糖)、低血糖6例。
一、典型病例
低血糖 患者因急性胰腺炎、胆囊炎,于2006年3月2日给予加替沙星氯化钠注射液0.2g,静脉滴注,日2次。在输液时出现腹痛、乏力、全身出汗,伴双下肢端抽搐。测血糖2.2mmol/L,给予静滴10% 葡萄糖注射液500ml,症状无明显好转。10分钟再次测血糖1.8mol/L,继续静滴葡萄糖,同时停用加替沙星,患者症状逐渐消失。
高血糖 患者因尿路感染,2006年2月11日给予加替沙星注射液0.4g,静脉滴注,日1次。2月17日患者出现意识不清、难以对答,测血糖33.52mmol/L(入院时空腹血糖5.6mmol/L)。立即停药,对症治疗,再测空腹血糖7.4mmol/L,症状消失。
二、高危险人群
1、糖尿病患者:多见于Ⅱ型糖尿病,一般正在使用降糖药。
2、肾功能不全者:加替沙星95%以原型从尿中排出,肾功能障碍患者对加替沙星的清除下降,因此必须调整剂量。
3、老年人:由于老年患者肾功能呈下降趋势,或存在其他潜在疾病,容易出现血糖异常。
4、并用影响血糖的药品:包括降血糖药品(如胰岛素、格列本脲)、其他可影响血糖的药品(如糖皮质激素)或影响加替沙星代谢的药品(如丙磺舒)等。
5、国外有肝损害患者发生血糖异常不良反应的报道。
三、血糖异常的特征
1、加替沙星引起血糖异常的相关性较为明确。血糖异常包括低血糖、高血糖、甚至高血糖高渗性昏迷。可发生在静脉滴注或口服加替沙星之后。
2、低血糖一般出现在用药早期(如用药后3天内),高血糖多在用药数天(如3天)后发生。
3、绝大多数患者在停药治疗后血糖都可恢复正常。但严重的高血糖或低血糖事件处理不及时,也可危及生命。
四、建议
鉴于加替沙星可导致血糖异常的严重不良反应,建议临床医师加强监护,提高警惕,必要时监测血糖。如已出现血糖异常不良反应,须及时停药,给予适当的处理,并考虑改用其他药品治疗,同时向相关部门报告不良反应。对于糖尿病患者、肾功能不全患者、老年人、合并使用降糖药或者影响血糖药品的患者应慎用此药,如需用药,应密切监测血糖。
患者必须在医生的指导下使用加替沙星。在治疗时应注意有无低血糖症状(如多汗、无力、饥饿、头晕、心悸、烦躁、意识模糊、嗜睡等)或高血糖症状(如多尿、口渴、疲劳、双下肢浮肿等)的发生。如出现上述症状,应立即咨询医生。患者如存在糖尿病、肾功能不全等疾病,或正在使用其他药品,尤其是降血糖药,应及时告之处方医师。