基本信息
【药物名称】福莫司汀 fotemustine
【药物别名】武活龙
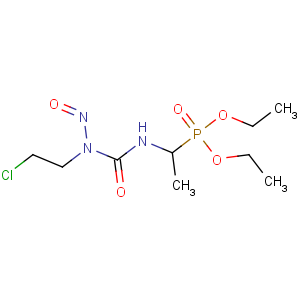
【分子式成分】(R,S)-二-乙基{1-[3-(2-氯乙基)-3-亚硝基脲基]乙基}膦酸酯
类别: 西医药物
性状:淡黄色冻干粉末,易溶于乙醇和水,对光敏感
【制剂规格】注射用冻干粉剂:208.0mg/瓶;200mg/4mL。淡黄色冻干粉末,易溶于乙醇和水,对光敏感。避光,2~8℃贮存。
药理毒理
福莫司汀为亚硝基脲类的抗有丝分裂的细胞抑制剂,具有烷化和氨甲酰基化作用,动物实验显示其有广谱抗肿瘤活性。其化学结构中含有一个丙氨酸的生物等配物(1-氨乙基磷酸)易于穿透细胞和通过血脑屏障。
临床评价
北京天坛医院神经外科用福莫司汀对40例术后确诊为恶性胶质瘤患者

骨髓抑制
进行了化疗方案为每周1次静脉给药,剂量100mg?m-2。定期随访并复查脑CT/MRI。12周结果为:2人完全缓解,9人部分缓解,22人病情稳定,7人病情恶化;30个月随访其中10人死亡(n=46)。临床研究表明,福莫司汀静脉化疗对于恶性胶质瘤是有效和安全的。福莫司汀以其能顺利通过血脑屏障和抗肿瘤活性较高的特性,是亚硝基脲类化疗的首选药物。毒性反应有骨髓抑制和胃肠反应及轻度肝功能损害,均可在停经后自行恢复。
对34例复发性脑胶质瘤的成人患者进行研究,每人给予福莫司汀100mg?m-2,静脉滴注,每周1次,连续3周,随之休息5周。维持治疗为每3周静脉滴注1次。结果有24例(70%)部分有较并稳定,有效和稳定的中位反应时间为56周,生存率在12个月的为24%,18个月的为16%,3例延长生存期超过100周。临床同样表明,福莫司汀可使2/3复发性恶性胶质瘤患者的肿瘤延迟发展。
药动学
人体静脉输注后,其血浆清除率依单次或二次幂动态变化,半衰期很短。其分子几乎全部经代谢分解,而且血浆蛋白结合率较低(25%~30%)。在一线化疗中,本品可提高血液方面的耐受性,以往未进行化疗的患者白细胞减少40.4%,曾经化疗过的患者白细胞减少48.9%;以往未进行化疗的患者血小板减少33.9%,曾经化疗过的患者血小板减少40.4%(n=153)。
体内过程
人静脉注射14C标记的本品,血浆原药浓度迅速下降,半衰期为23.2分钟,分布容积为32L。
血浆清除率与肝脏血流量有关,为1100ml/min;主要从尿中排出,7日后尿排泄>50%,粪中排出<10%,呼吸中以CO2形式排出<0.1%。
本品有较好的细胞膜穿透性及组织分布,能透过血脑屏障,在亚硝脲类药物中,其穿透力最强。
适应证
【适 应 证】原发性脑内肿瘤和播散性恶性黑色素瘤(包括脑内部位)。
(1)恶性黑色素瘤和晚期癌症。
(2)不宜手术的原发性脑肿瘤。
(3)多发性淋巴转移性恶性肿瘤和白血病。
不良反应
【不良反应】主要为血液学方面的影响,以血小板减少(40.3%)和白细胞减少(46.3%)为特征,发生较晚,分别在应用首剂诱导治疗后4~5周和5~6周达最低点。若在本品治疗之

肝脏
前进行过其他化疗和/或与其他可能诱发血液毒性的药物联合应用时,可加重血液学毒性。此外还有用药后2h内出现中度恶心和呕吐(46.7%)、中度暂时性可逆性转氨酶、碱性磷酸酶及胆红素升高(29.5%)、发热(3.3%)、注射部位静脉炎(2.9%)、腹泻(2.6%)、腹痛(1.3%)、暂时性血尿素氮升高(0.8%)、瘙痒(0.7%)、暂时性可逆性神经功能障碍(意识障碍、感觉异常、味觉缺失)(0.7%)。
相互作用
本品与大剂量的达卡巴嗪(400~800mg?m-2)合用出现肺部毒性表现(成人呼

血细胞
吸窘迫综合征),当联合应用时,推荐按照下列交替用药方案:本品d1和d8各用100mg?m-2;达卡巴嗪d15,d16,d17,d18连续用,剂量为250mg?m-2?d-1。
与所有细胞毒药物有相同的相互作用
1.因为肿瘤增加了血栓的危险,通常采用抗凝血治疗。肿瘤病例中血液凝固性存在很大的个体间差异,从而增加了口服抗凝血剂与抗肿瘤化疗之间相互作用的不测事件。因此,如若决定患者口服抗凝血剂治疗,需要增加INR检验的次数。
2.联合用药禁忌
1)苯妥英(为了预防某些抗肿瘤药物诱发的惊阙时应用)
应用阿霉素、柔红霉素、卡铂、顺铂、卡莫司汀、长春新碱、长春碱、博来霉素、甲氨蝶呤时,由于细胞增殖抑制剂导致苯妥英在消化道吸收的减少,从而诱发惊阙的发作。可短时间与抗惊厥的苯二氮卓类药合用。
2)黄热病疫苗引致广泛致命的疫苗疾病的危险。
3.联合用药需考虑
1)环孢菌素(阿霉素、依托泊甙);可能有过度的免疫抑制,导致淋巴组织增生的危险性。
2)免疫抑制剂(由环孢菌素外推法得出);过度的免疫抑制,导致淋巴细胞增生的危险性。
4.本品与达卡巴嗪特定的相互作用:
当本品与大剂量的达卡巴嗪在同一天同时应用时偶尔会发生肺毒性(急性成年人呼吸窘迫综合症),注意避免此种给药方法。

白细胞
应根据下述推荐方法进行联合用药:
1)诱导治疗:
福莫司汀100mg/m2/天,在第1天和第8天。
达卡巴嗪250mg/m2/天,在第15,16,17和18天。
5周的治疗休息期。
2)维持治疗?莫司汀100mg/m2/天,第1天。
达卡巴嗪250mg/m2/天,在第2,3,4,5天。
用法用量
准确取4mL无菌的酒精溶媒,溶解小瓶中的福莫司汀,剧烈振摇,直到粉剂完全溶解,将福莫司汀溶液加入5%的葡萄糖溶液250mL,作静脉滴注。依此法制备药液时时应避光,静

粒细胞
脉缓慢滴注1h。静脉注射给药,每次剂量100mg/平方米,1次/周,连续给药3周,之后进行常规维持治疗,每3周给药1次。注射剂,4ml/支,含药200mg;2ml/支,含药100mg。
(1)治疗过程中应密切检查血常规,特别注意血小板和中性粒细胞数的改变,并及时调整剂量,血小板低于9万/立方毫米,白细胞低于3000/立方毫米要特别注意,或停药待其适当恢复。(2)留意肝、肾功能改变。(3)胃肠道症状可适当对症处理。
单一药物化疗包括诱导治疗:连续用药3次,各间隔1周;然后是治疗休息期4~5周;维持治疗:每3周用药1次。标准剂量均为100mg?m-2。在联合化疗时,免去诱导治疗的第3次用药,剂量仍维持不变。
注意事项
怀孕及哺乳期妇女禁用。
①不推荐将本品用于过去4周内用过化疗或6周内用过亚硝

黄热病
基脲类药物治疗的患者。
②本品只可考虑用于血小板和/或粒细胞计数分别≥1×1012?L-1和≥2×109?L-1的患者。每次用药前,都应做血细胞计数,并根据血液学状态调整剂量。
③从诱导治疗开始到维持治疗开始,推荐的间隔是8周,在2个维持治疗周期之间,推荐的间隔期是3周。推荐在诱导治疗中或后进行肝功能检查。
制剂规格
注射用冻干粉剂:208.0mg/瓶;200mg/4mL。
避光,2~8℃贮存。
禁忌
对本品过敏,造血功能不良和孕妇禁用。
生产单位
法国施维雅国际公司、批准文号:X19990010
国药一心制药有限公司、国药准字H20067228